Research
Section I -ビジョンと理論基盤
Ⅰ-1. 「薬を減らす医学」というパラダイム
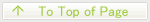
医薬品の進歩は人類の寿命を劇的に延ばした一方、「大量製造 → 大量投与 → 薬依存」 という負の連鎖を助長してきました。
製造コスト、医療財政、環境負荷、そして副作用――これらを同時に縮減するために、瀧研究室は 2013 年から “One-Shot, Side-Effect-Free, Drug-Minimal Society” を目指した研究を行っています。
目標は、一度の投与で長期に作用し、しかも標的疾患蛋白質以外には一切触れない薬剤 を現実に落とし込むこと。
その鍵のひとつが「中分子」共有結合型阻害剤(biological Target Covalent Inhibitor; bioTCI) です。
注)bioTI=可逆型, bioTCI=不可逆(共有結合)型
Ⅰ-2. bioTCI がもたらす三つの利点
1. 長期薬効
――標的疾患蛋白質と不可逆共有結合を形成するため、薬物動態(PK)に左右されずに薬効(PD)を維持。
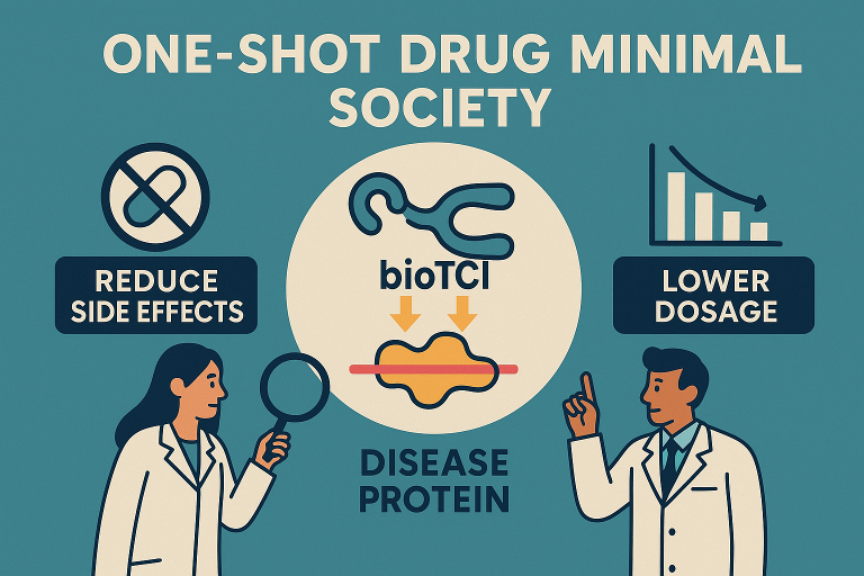
2. 高特異性 & 低副作用
――ペプチドや核酸といった「中分子」は多点相互作用で標的疾患蛋白質を厳密に認識するため、副作用の主因となるオフターゲット反応を劇的に抑制。
3. 柔軟な化学設計
――合成化学・進化分子工学・クリックケミストリーを自由に組み合わせ、迅速簡便な構造最適化が可能。
FAQ: なぜ「中分子」なのか
・安全性:標的の多点認識により副作用を抑制
・合成容易性化学/酵素反応で自由自在に改変可能
・開発スピードライブラリ技術+迅速選択(HTS)による短期間最適化
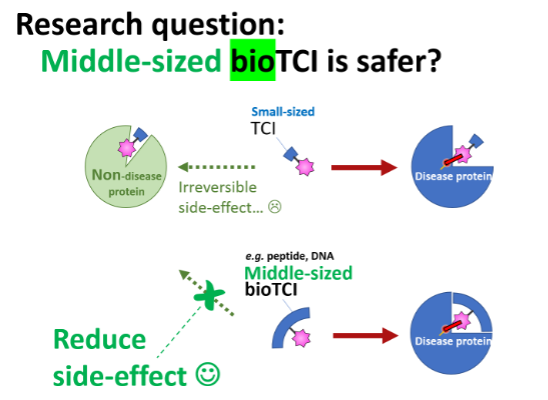
課題と戦略
・「非」共有結合性の中分子医薬(bioTI)の弱点は、酵素分解に対する脆弱性と腎排泄の速さ。
・TCIの弱点は、非特異的結合による永続的副反応。
↓
これらを克服する技術開発が本研究室の軸となります。
① 共有結合後:標的蛋白質との結合でbioTCIは「自己カプセル化」して分解酵素をブロックするとともに、分子量増大により腎排泄しづらくなる。
② 共有結合前:Fc 融合などの“半減期延長”化学を併用する。
③ 共有結合時:潜在性 warhead (反応起点)を使い、ヒト体内のどこにも存在しない“微小反応場”でのみ厳密に共有結合が進行する仕組み(Trigger & Lock機構)を導入する。
Ⅰ-3. 理論基盤層:レイヤー
| レイヤー(層) | ラボの技術と方向性 | 要点 |
|---|---|---|
| 化学層 | 10BASEd-T (10BT) on T7 phage, NEXT-A, Affinity/Reactivity Co-selection (ARC; ARC-10BT; ARCaDia) | 生体適合かつ操作性の高い共有結合反応, Trigger & Lock型コンビナトリアル選択技術 |
| 計算層 | bioTCI hub (NGS × MS × MD × AI) | 親和性+反応性+動的構造を統合学習 |
| 計測システム層 | Force-Responsive Materials/Device Co-invention | 力学刺激と薬理作用をリアルタイム統合 |
この多層アーキテクチャこそが“薬をほとんど使わない未来医療” の基盤です。
I-4. 未解明の科学的課題 ― “基礎理学”(純粋学術/学究)が拓く応用
I-4-1. 微小反応場(Match-Making Microenvironment; MM-ME)の謎
潜在性 warhead (latent SuFEx など)は水溶液中で全く不活性にもかかわらず、標的蛋白質に結合した瞬間に反応速度が数千倍に跳ね上がる場合がある。
これは単なる「近接効果」だけでは説明できず、“触媒回転数ゼロの酵素” とも呼ぶべき MM-MEが形成されていると考えられる。
・静電場・水素結合ネットワーク・脱溶媒和 による潜在性求電子中心の電子構造変換?
・サブ‐ピコ秒スケールのダイナミクス:蛋白質揺らぎと溶媒再配列が協奏的に反応座標を押し上げる?
標的蛋白質とbioTCIとが織りなすミクロ反応場を解剖することが、bioTCI を理論設計可能なモダリティへ昇華させる鍵である。
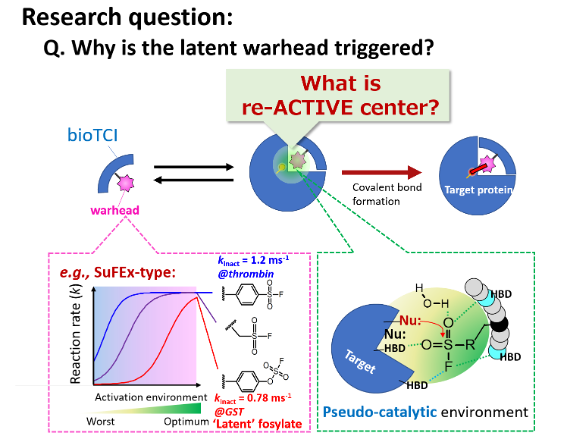
問い:潜在性warhead覚醒の現場は捉えられる?
I-4-2. 弱/一過的相互作用の本質的役割生体内で最初に起こるのは “weak / transient”(Kd μM-mM, τ μs-ms)な遭遇複合体(encounter complex)におけるモチーフ形成であり、 bioTCI探索時のみならず、天然(自然界)における核酸/蛋白質複合体の形成においても、この‘見えざる’過程がキモであると考えている。 人間にたとえると、関係を深める前にまず軽く握手を交わし、’手探り'で何となく相手の感触(相性)を掴むのと似ている。 我々の系では、1) 複合体の立体配置をプリオーガナイズし、2) 反応場を「熟成」させてから、3) 不可逆共有結合へと雪崩れ込ませることで、弱/一過的相互作用をフリーズできる。 今後、弱/一過的相互作用を正確に定量・可視化 することで MM-ME の真価を検証できると考えており、これを探求する。
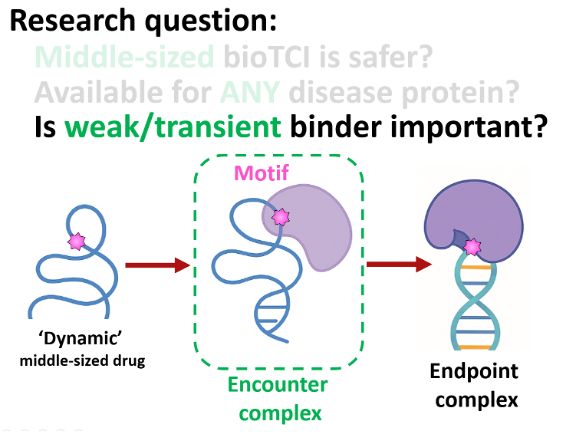
問い:生体はまず弱い握手から始め、遭遇複合体がMM-MEを醸成する?
↓
Weak/Transient Motif-Finder:
・NGS(ARC 出現頻度)+クロスリンク MS/MS(共有結合位置)+粗視化 MD を一体解析し、X-ray/NMR が苦手な μs スケール複合体を “計算上で凍結”。
・AI が 短いコアモチーフ(3-6 aa / nt)を提案 → 新ライブラリへフィードバック。
・時間とコストがかかる物理構造決定を“バイパス”しつつ、真に重要なエピトープのみを抽出。
Section II -技術概念と年表(主な成果とマイルストーン)
瀧研の目的, 目標, およびマイルストーン:
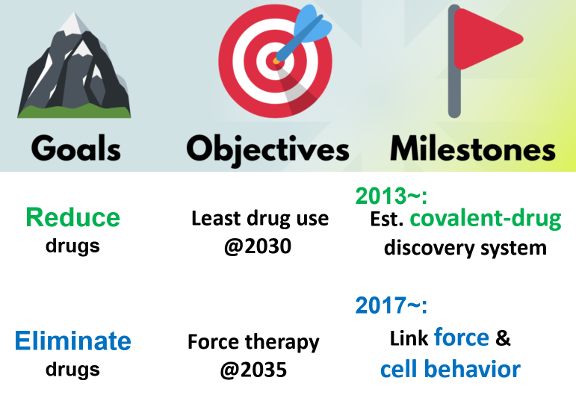
Ⅱ-1. 瀧研究室の技術年表:主な成果とプラットフォーム (2013 -2025)
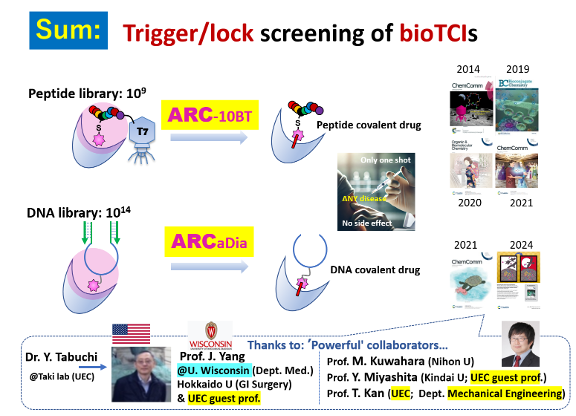
成果の要点:bioTCIのコンビナトリアル選択(ARC)技術を確立;小規模ラボなので、本学客員教授ほか様々な専門性を持つ研究者達との連携(共同研究)は欠かせません。
ラボの年表:
| 年 | ハイライト | 鍵論文 |
|---|---|---|
| 2013- | 10BASEd-T 反応 (10BT) を発見し、T7 ファージ上ペプチド・ライブラリ内へ自在に warhead(共有結合反応起点)導入可能に→bioTCI実験開始 (鹿児島大伊東先生との共著; 瀧研第一号Ph.D.である第一著者の福永先生は現宮崎大の准教授) Gp10 based-thioetherification (10BASEd-T) on a displaying library peptide of bacteriophage T7 |
Mol. BioSyst. 2013 |
| 2018~2019 | 1)10BTを介した間接取得法 (モック warhead) により世界初のペプチド型 bioTCI のコンビナトリアル選択 を実証; 反面、10BT直接取得法は決定打が無く試行錯誤続く Combinatorially Screened Peptide as Targeted Covalent Binder: Alteration of Bait-Conjugated Peptide to Reactive Modifier 2) NEXT-A反応によるbioTIへのFc精密融合(安定性向上; 味の素㈱との共著) Facile and Efficient Chemoenzymatic Semisynthesis of Fc-Fusion Compounds for Half-Life Extension of Pharmaceutical Components 3) 歪みで蛍光色の変わる生体適合性mechanoゲルを初開発(薬を使わず 疾患細胞を操作する“応力”治療概念の芽生え; スイス ETH Vogel先生および慶応大山下先生との共著) GMechano-chromic protein?polymer hybrid hydrogel to visualize mechanical strain |
1) BC, 2018 2) BC, 2019(Front Cover) 3) Soft Matter, 2019 (Back cover) |
| 2021 | ARC-10BT =Affinity/Reactivity Co-selection: 潜在性 warhead を使ったTrigger & Lock機構でのペプチド型bioTCI直接取得法を確立 Direct screening of a target-specific covalent binder: stringent regulation of warhead reactivity in a matchmaking environment |
ChemComm, 2021 (Hot & Front Cover) |
| 2024 | ARCaDia: 1 ラウンド・Non-SELEX で DNA アプタマー型 bioTCI を 超迅速に取得(米UW/北大医学部 Yangほかとの共著) ARCaDia: single-round screening of a DNA-type targeted covalent binder possessing a latent warhead |
ChemComm, 2024 (Back cover) |
| 2025~ | bioTCI hub(NGS×MS×AI による反応プロファイルDB)、MechanoDB(3D応力イメージングプラットフォーム)始動 | - |
・ペプチド型 およびDNA型bioTCI はいずれも 共有結合後に血清/ヌクレアーゼ耐性を獲得。
・DNA型bioTCI は 相補鎖 CS 投与で薬効をオンデマンドに中和できる。
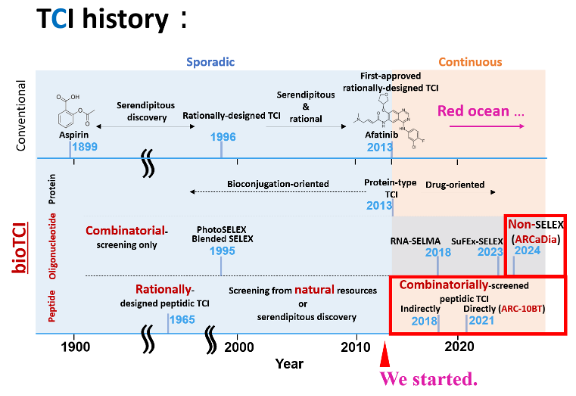
Ⅱ-2. (bio)TCI研究史における当ラボの位置づけ(赤枠)
Ⅱ-3. 技術を支えるキーコンセプト
IⅡ-3-1. 潜在性 Warhead
SuFEx 型 Aryl-OSO2F(米国Sharpless et al., 2018) を代表とするlatent warhead は、水中では不活性だが 蛋白質内部の擬似触媒環境 でのみ覚醒します。 この “局所活性化” が副反応を限りなく抑制し、以下のARC が 1 回で完結する原動力となります 。 覚醒時の反応速度の爆上げが可能であり、なおかつ蛋白質中の異なる求核性アミノ酸に幅広く対応可能なlatent warheadは未だ存在しないため、これを設計すべく今後注力していきます。
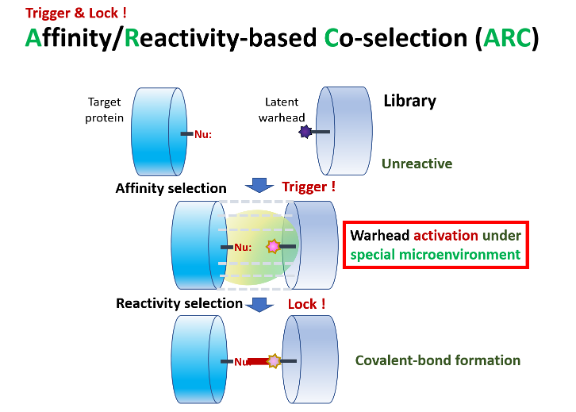
Ⅱ-3-2. Affinity / Reactivity-based Co-selection (ARC)
1) 標的親和性で「足止めと反応場形成」→ 2) 反応活性で「確定」(Trigger & Lock)
――この 二段階認証 により副反応を徹底排除。ペプチド版 ARC-10BT と核酸版 ARCaDia は共通して、 “時短と手順の簡素化” も併せて可能にします 。
Section III -今後の研究の二本柱(2025-)
1.bioTCI hub:多層データ統合プラットフォーム
One-Shot Therapy を真に制御可能にするには、“弱結合 → MM-ME → 共有結合” の一連反応を数式化して作用機序を定量モデルとして記述することで、個々の患者蛋白質変異にも対応できる設計指針が不可欠です。
MM-ME 物理モデルと Weak/Transient Motif-Finderの確立がその礎となります。
・NGS ビッグデータや質量分析(MS)および分子動力学(MD)計算などからモチーフ配列-親和性-反応性 を同時に抽出する AI-駆動解析
・ Reactivity-AI モジュールで新規 warhead の反応場を予測
・数十種類以上の latent warhead-protein 複合体で 反応座標の自由エネルギー地形 を描き、“活性化クラスター” 共通指紋を抽出
→特異的反応場 (MM-ME)の構造/反応機構や、生体分子間の一過的相互作用の本質解明
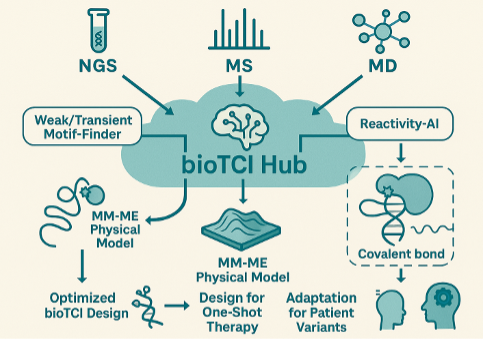
bioTCI hub:MM-MEを解明しつつ基礎学術と応用を繋ぐ.
2.力学療法を視野に入れたメカノ3次元イメージング(Mechano-3D Imaging & Force Therapy)
・新規光学材料(ハイドロゲル) × 高感度レーザー光学測定系の共開発で、細胞の三次元応力場リアルタイム可視化
・これにより、癌細胞のような病態細胞が周囲に与える力学的な影響をμmの分解能で捉え、細胞の力学変化と生理現象(例:癌の悪性化、骨形成活性化)との詳細な相関を明らかにすることを目指す
・将来的に、In vivo/Ex vivoで細胞の秘孔を突いたり、幹細胞を力で分化させたりして“薬を使わない治療”(Force Therapy, 2035―)への応用を探る
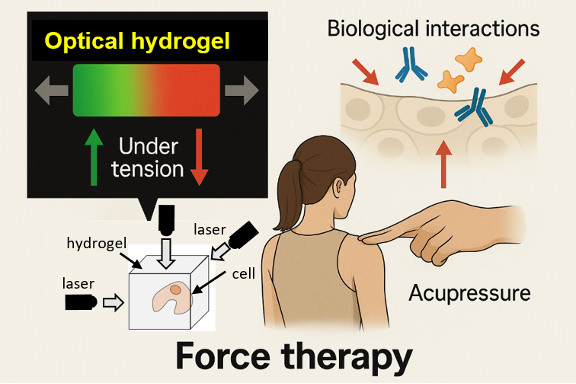
MechanoDB:応力治療を目指した複合材料/光学システム同時開発のイメージ(国立天文台・都丸教授らとの共同研究)