瀧研ってどんなところ?
瀧研の研究目的や目玉研究は?
薬をなるべく(すく)なくすることを目的として研究しています。少量で長く効く新たな薬剤形態(モダリティー)として、
「分子標的薬を志向した人工中分子」を創成しており、その中でも特に「中分子共有結合薬(bioTCI)」の取得に注力しています。
例えば、ガン細胞などの疾患分子に結合するbioTCI を取得すれば、1 回の投与で持続的な疾患治療につながります。
以下は初学者(高校/大学初等クラス)向けの簡単な解説記事ですが、HPには書けないmysterious secret projectも常に2~3件進行しています。
★ 中・高分子型の共有結合薬(bioTCI)についての総説
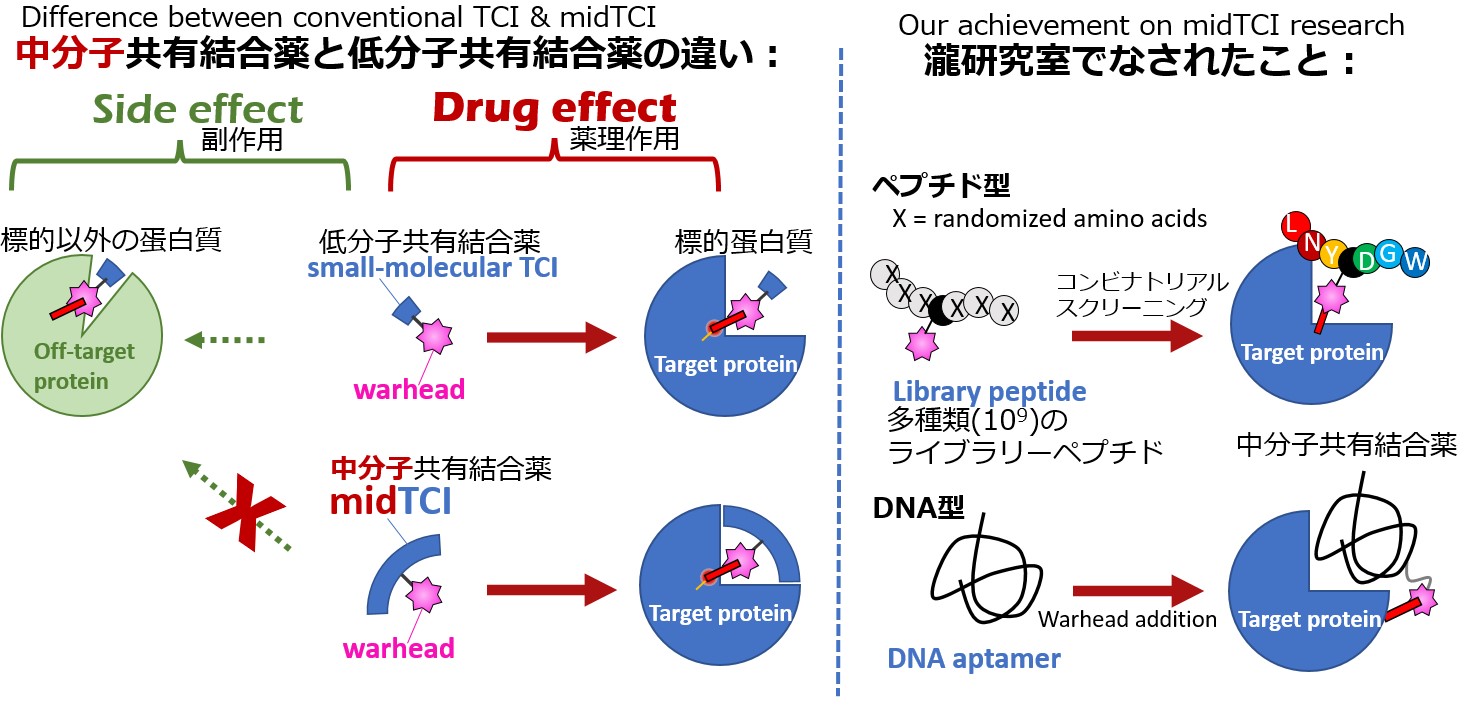
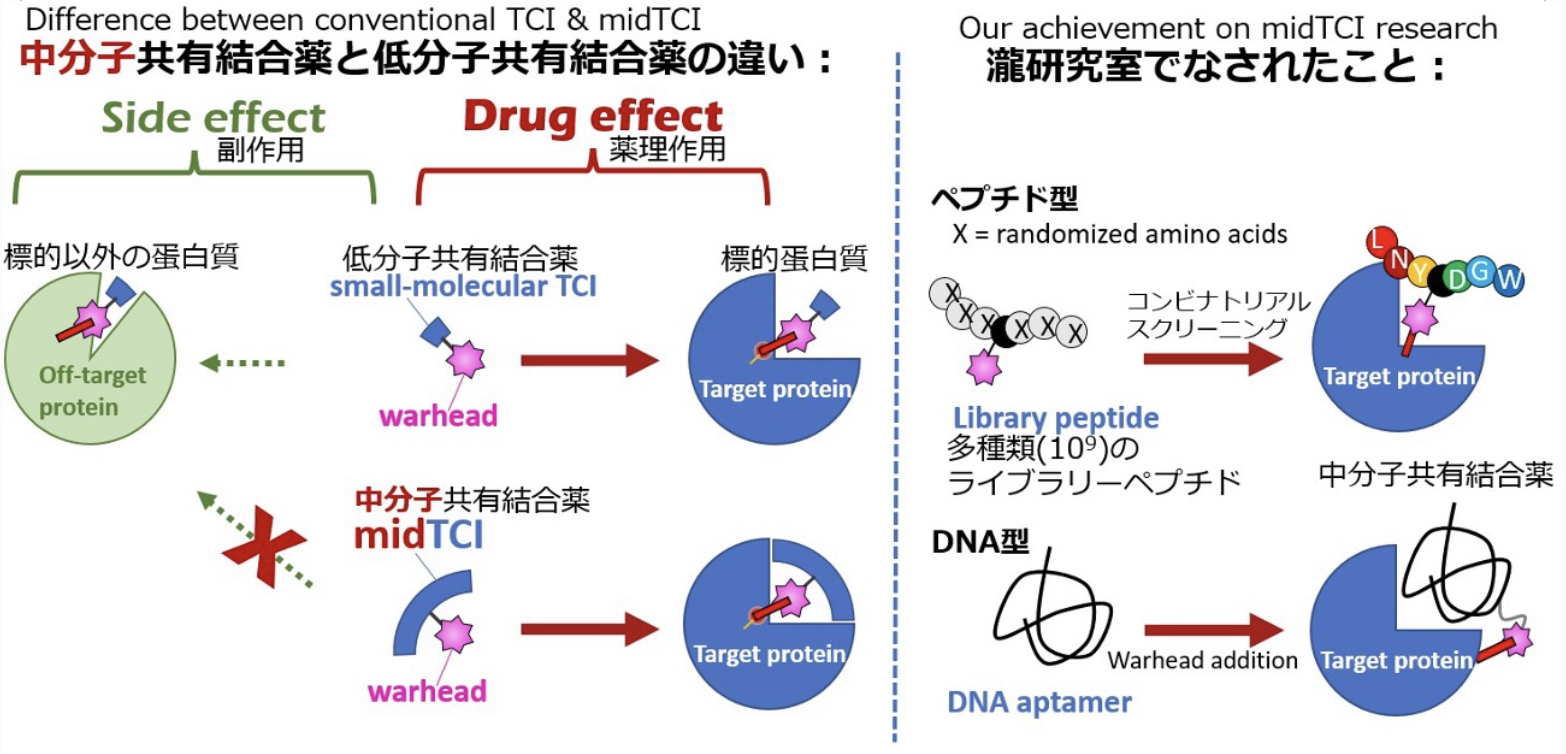
アスピリン(バファリン)に代表される共有結合薬(Targeted Covalent Inhibitor; TCI)は、120年以上の長い歴史を持ち、そのほとんどが低分子です。私たちは、低分子TCIよりも分子標的性の高い、中・高分子型の共有結合薬(bioTCI)に着目し、その中でも特に作製が容易な「中分子bioTCI」(midTCI)に特化した研究開発を行ってきました。具体的には:
① ペプチド型TCIのコンビナトリアルスクリーニング
② DNAアプタマーのTCI化
を、世界に先駆けて報告してきました。これらを含めた、bioTCIの歴史的背景および最新の動向を、総説として発表いたします。なお、コンビナトリアルスクリーニングとは、多数(10^9種類)の候補化合物の中から分子標的性TCIを選び出す方法であり、DNAアプタマーとは、分子標的性を持つDNAのことです。
bioTCIs: Middle-to-Macro Biomolecular Targeted Covalent Inhibitors Possessing Both Semi-Permanent Drug Action and Stringent Target Specificity as Potential Antibody Replacements
by Jay Yang, Yudai Tabuchi, Riku Katsuki, and Masumi Taki
Int. J. Mol. Sci. 2023, 24(4), 3525; https://www.mdpi.com/1422-0067/24/4/3525
In Topical Collection "State-of-the-Art Molecular Immunology in Japan"
オープンアクセスなので、どなたにもお読みいただけます。
★ 最近の研究成果
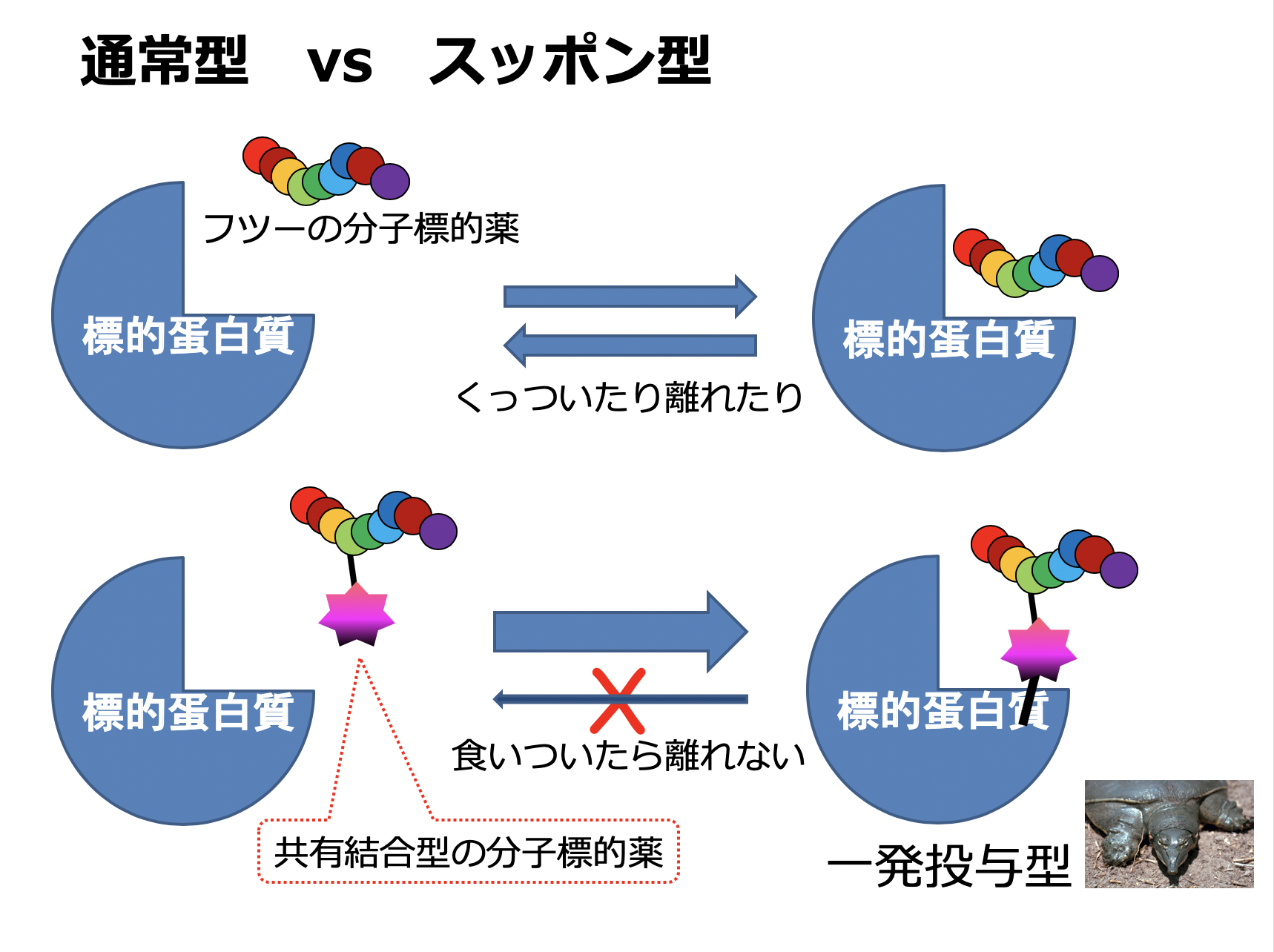
1.スッポン型中分子薬剤(中分子コバレントドラッグ)
副作用なく不可逆(永続)的に疾患関連白質のみを阻害する薬剤の探索システムを確立することで、薬剤投与を最小回数で済ませること(患者のQOL向上)を目的として、標的蛋白質だけに不可逆的に共有結合する中分子型共有結合性薬剤(middle-molecule covalent drug;ラボ内スラングで「スッポン型中分子」)の開発研究を行っています。
★スッポン型開発の歴史:
スッポン型は、アスピリンに始まり100年以上の長い歴史を持つ薬剤概念ですが、我々が「中分子コバレントドラッグ」の可能性を信じて実験を開始した2013年頃は、中分子はおろか低分子においてもコバレントドラッグの新規報告例は滅多にありませんでした。不可逆的に共有結合する生理活性物質は、薬(drug)というより毒(toxicophore)のイメージが強く、科学的根拠よりも「何となく怖いもの」という漠然とした理由で敬遠され続けていたのではないかと推測しています。我々は、もしも本当に標的以外への不可逆的結合(副作用)が問題となるのであれば、分子標的性を多点認識で極限まで高めればよいのではないかと考え、低分子ではなく中分子biologicsを薬剤モダリティーとして選び、これに注力してきました。
1-1. DNA型

世界初の概念である、DNA型共有結合性薬剤(DNA covalent drug)を提唱しました。
Tabuchi et al., Chem. Commun., 57, 2483-2486 (2021); doi: 10.1039/d0cc08109d.
https://pubmed.ncbi.nlm.nih.gov/33625415/
水中で、標的の蛋白質に共有結合で強く喰いついて二度と離れませんが、相補鎖を加えると任意のタイミングで「共有結合させたまま解毒」できるところもミソです。市販の化合物から1段階の教科書反応(SN2反応)で誰でも作れるFig 2aの新規化合物1がポイントであり、電気泳動とかLC-MSとか、学部でならっている古典的基礎実験だけで成り立っているシンプルな系が特徴の論文です。今から30年前でも十分実施・完結できる内容なのですが、ずっと見逃されてきたことの中に、全くの新しさが隠れていることを田淵君が見逃さずに発見しました。世の中も学術も複雑化しすぎていますが、基本とか基礎ってすごく大事だと、改めて思います。
1-2. ペプチド型
ライブラリーペプチドからの共有結合性薬剤の直接的取得
Y. Tabuchi, T. Watanabe, R. Katsuki, Y. Ito, and M. Taki*, Direct screening of a target-specific covalent binder: stringent regulation of warhead reactivity in a matchmaking environment, Chem. Commun., 57, 5378-5381 (2021), selected as a hot/cover article;
https://doi.org/10.1039/D1CC01773J

ライブラリーペプチドからの共有結合性薬剤の間接的取得
S. Uematsu et al., Combinatorially Screened Peptide as Targeted Covalent Binder: Alteration of Bait-Conjugated Peptide to Reactive Modifier, Bioconjugate Chemistry, 29, 1866-1871 (2018).
Open repository :
https://uec.repo.nii.ac.jp/?action=pages_view_main&active_action=repository_view_main_item_detail&item_id=8864&item_no=1&page_id=13&block_id=21
派生研究:蛋白質結合性ペプチドを光架橋させることで、蛋白質のどのサイトに結合したかがMS/MSで分かる、という内容です。 K. Yatabe et al., A Cysteine-reactive small photo-crosslinker possessing caged-fluorescence property: binding-site determination of a combinatorially-selected peptide by fluorescence imaging / tandem mass spectrometry, International Journal of Molecular Sciences, 19, 3682 (2018). Open access:https://www.mdpi.com/1422-0067/19/11/3682
中分子共有結合薬(bioTCI)の取得
注)「中分子共有結合薬(bioTCI)の取得」の以下の文章が、何を言っているのか分からない! という初学者(高校/大学初等クラス)の方は、「配属前学部生向け:瀧研ってどんな研究室?」に書いた簡単な解説記事をご覧ください。
Mission/Aim in brief:
バイオロジクス(biologics; components of living organisms)をベースとした targeted covalent inhibitors (bioTCIs)は高い反応特異性を持ち,少ない投与量で持続的な 薬効を示し,副作用のリスクを大いに低減し得るものと考えている.バイオロジクスの中でも, ペプチドや核酸のような中分子は,腎排泄および酵素分解による血中安定性の低さが問題とな るが,TCI 化によって共有結合を形成することで,薬物体内動態(PD)とは独立した長期的な 薬効を示すことが可能となると思われる.また,適切なセレクションにて得られ た天然構造を主骨格とする中分子型TCI が,標的タンパク質と共有結合を形成 した後に,酵素分解から逃れることも確認している.これらは,同中分子がTCI 化によって生体内での使用に耐え得ることを示唆しており,従来は不向きとされてきた同モダ リティの臨床応用への可能性を見据えた,基礎学術および技術展開を行いたい.大量の医薬品 が供給・消費され続ける現代社会から,より良い薬剤をより少なく供給・消費する社会への転 換を視野に入れて, 一石を投じる研究をしたい.
Our achievement
共有結合性阻害剤(Targeted Covalent Inhibitor; TCI)とは、標的生体分子に対して共有結合を形成して標的を半永久的に阻害する物質のことであり、TCI 関連論文数および特許数が近年急増している(Bethany, Chem. Eng. News, 28,2020)。我々は、抗体のように厳密な多点分子認識による標的阻害が可能であり、 かつ低分子阻害剤のように化学合成が容易な中分子TCI(bioTCI)に特化した研究開発を2013 年から行っており、特に、①ペプチド型TCIの網羅的探索(コンビナトリアル選択) および、②DNAアプタマーのTCI化と半永続的薬効の除去を、世界に先駆けて報告している(図)。
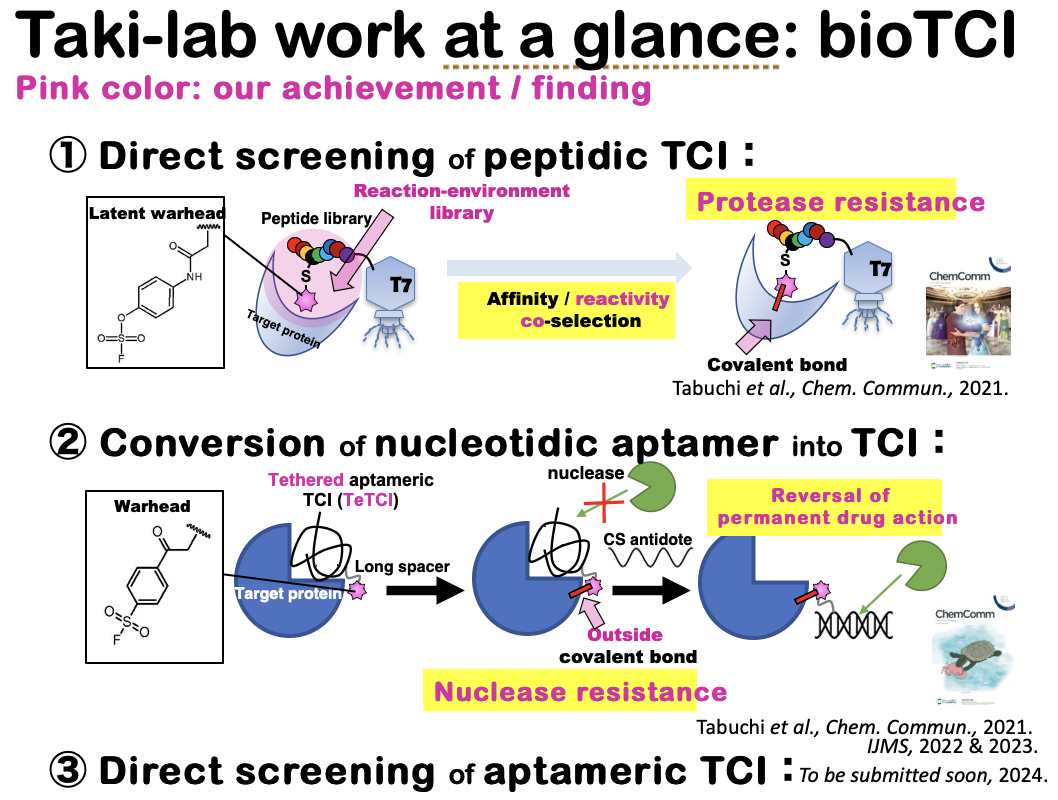
また、①および②のどちらの分子形態 (モダリティー)においても、共有結合後の血清中安定性が向上していることを見出している。
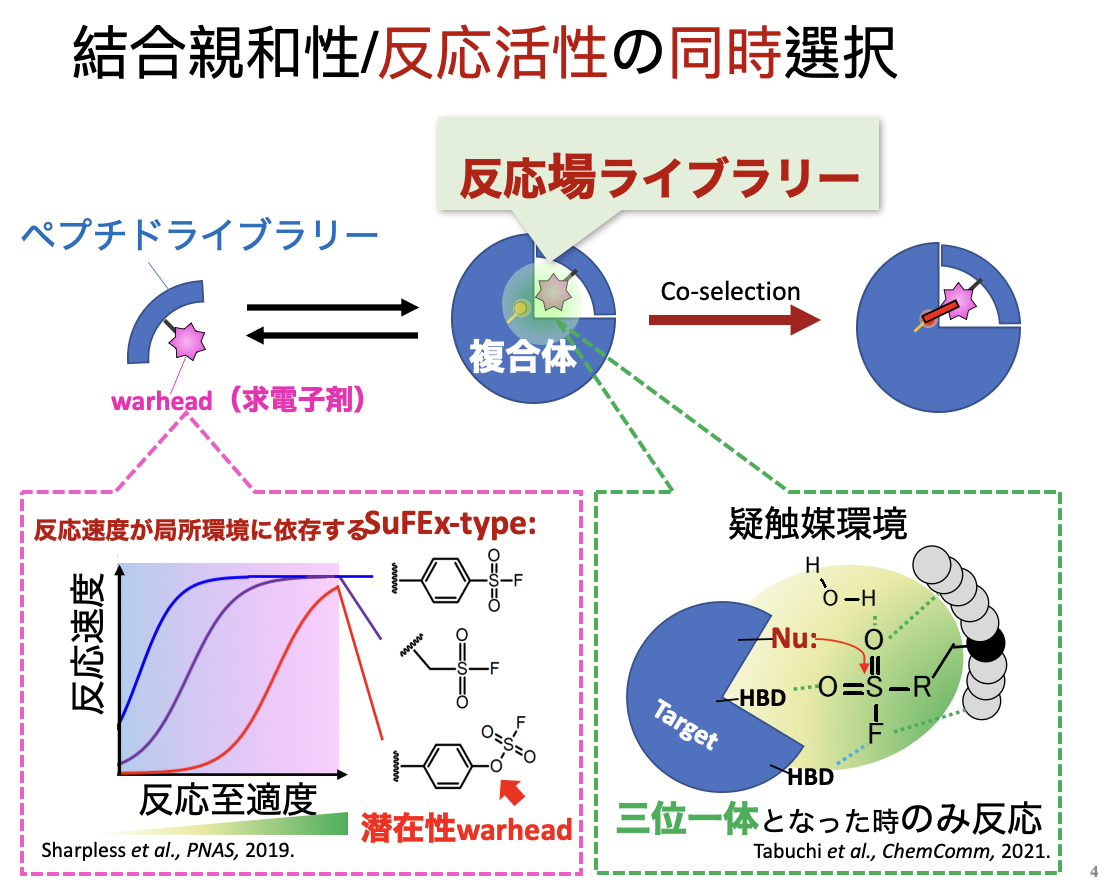
①TCI:中分子共有結合阻害剤(bioTCI)のコンビナトリアル選択時に形成される特異的反応場
様々な生体分子が混在する環境下で、TCI が標的蛋白質だけに厳密に共有結合するためには、極力弱い求電子性の反応基(warhead)を、標的特異性を持つリガンドの特定位置に 組み込んで、生体直交性の高いTCI を作製する必要がある(Copeland,Methods Biochem. Anal., 340,2013)。つまり、warhead の持つ求電子性の微調整(Ojida, Bioorg. Med.Chem., 116386, 2021)がTCI の性能を左右する。これまでに報告されているwarhead の中でも、硫黄-フッ素交換(SuFEx)反応型のものは周辺環境依存的な反応性を示す ことが知られており(Sharpless, PNAS, 18808, 2019)、フッ化スルホニル基(R-SO2F)に対して標的蛋白質中のアミノ酸または水分子が複雑な水素結合等を形成することで初 めて、その反応が活性化される場合が多い。なかでも、アリールフルオロ硫酸エステル基(Aryl-OSO2F)は潜在性warhead とも呼ばれ、水中で一切の加水分解を受けないほど全く の不活性であるにもかかわらず、標的蛋白質の内側に形成されうる特異的反応場に適切な配向で結合した場合に限り反応活性となり、様々な求核性アミノ酸に対して共有結合するこ とが知られている(Sharpless, PNAS, 2019)。我々は、Aryl-OSO2F にペプチドライブラリーを付与して多様化させた後、これをモデル標的蛋白質(glutathione-S-transferase; GST)に作用させることで、GST に対する標的親和性と反応活性とを同時に有するペプチド型TCI を迅速選択することに成功している(図; Chem. Commun., 5378, 2021; hot and front cover article)。
bioTCIの血清中安定性:
我々がペプチド型TCI を作製するにあたり、標的と共有結合させることでペプチドの分子量を上げて腎排泄を抑制する着想は当初から持っていたが、実験の過程で意外にも、ペプ チドと標的とを共有結合させるだけで、プロテアーゼ分解から逃れ、安定性が向上することが分かった。具体的には、コンビナトリアル選択したペプチド型TCI を、標的であるGST 蛋白質と共有結合させた後、血清中にて37°Cで24 時間インキュベートしても同ペプチド型TCI は加水分解されなかった。
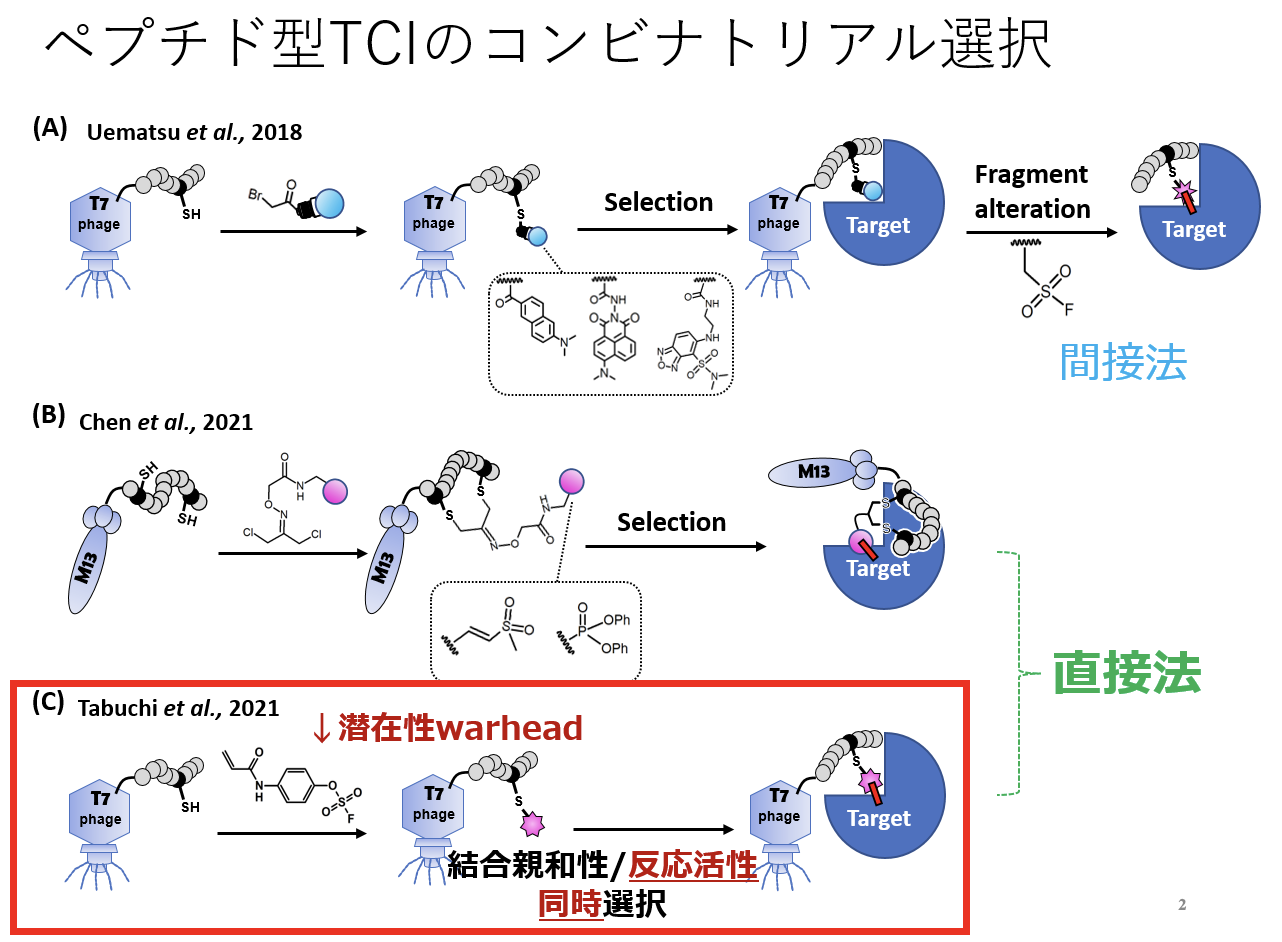
peptidic TCIのコンビナトリアル選択の歴史:
コンビナトリアルスクリーニング手法でペプチド型TCI を取得するにあたり、当初はライブラリーの構築中またはセレクション操作中のwarhead の反応性制御が困難であり, バイオロジクス間の非特異的な共有結合の形成を制御できなかった。そのため我々は、warhead を結合させたライブラリーから直接的にペプチド型TCI を取得することからい ったん離れ,間接的な手法を用いてペプチド型TCI の取得を行うことから着手した.具体的には,反応性を持たない幾つかの「おとり構造」をwarhead のかわりとして用いて ,それぞれの構造を含むペプチドライブラリーをT7 ファージ上に構築した.その後,モデル標的タンパク質であるグルタチオン-S-トランスフェラーゼ(GST)に対して選択を 行った後,共通して現れたペプチド配列中の「おとり構造」をwarhead に付け替えることでこれを達成した(図A)。ペプチド型TCI が,ライブラリーから直接的に取得された のはごく最近のことであり,2021 年にBogyo 先生らのグループ(図B),および我々のグループ(図C)により独立に発表がなされた.
②DNA-aptameric TCI:共有結合後の薬効の中和
ペプチド型TCI は低分子型TCI と比較して,高い反応特異性を有しており,TCI の抱える副作用のリスクを大いに低減するものと考えられるが、それでもなお,TCI の投与後に予
期せず副作用が起きた場合や薬効が強すぎた場合には、不可逆的な結合であるがゆえに薬効の中和は困難である。我々は、共有結合後に薬効の中和が可能である核酸アプタマー型の
TCI 開発も併せて行ってきた。
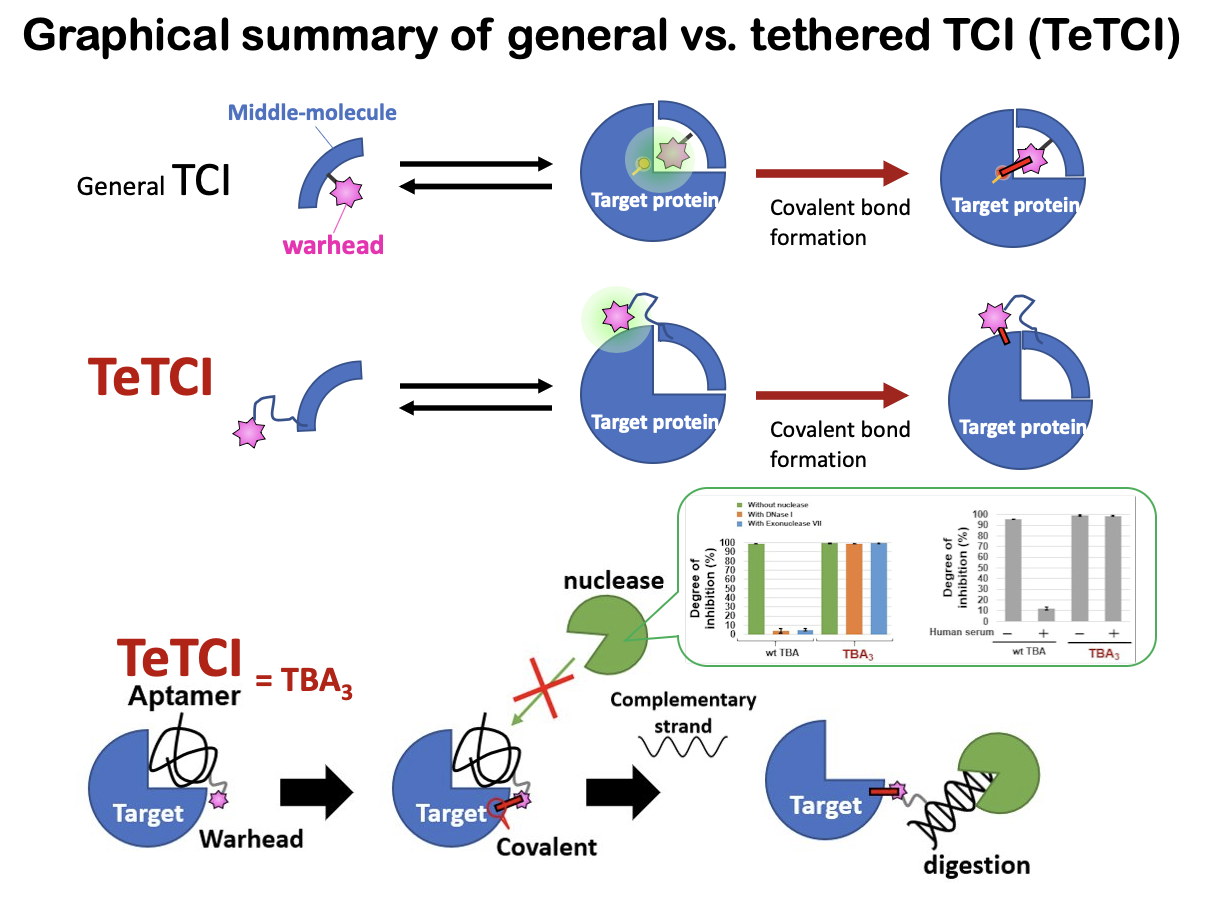
核酸アプタマーとは一本鎖核酸オリゴマーから成る分子であり,複雑な高次構造を取ることで,高い標的結合能および特異性を示し得る.さらに,核
酸アプタマーに相補鎖を加えてヘリックス型の二本鎖を形成させることで複雑な高次構造を解消し,その薬効を中和することが可能である.我々はこの特性を利用することで,標的
タンパク質を共有結合的に阻害した後でも,相補鎖を加えることでその半永久的な薬効を中和できるのではないかと考えた.具体的には,核酸アプタマーに長鎖リンカーを介して
warhead を導入することでtethered-TCI (TeTCI)型として,アプタマーの標的タンパク質阻害部位から離れたサイトに共有結合を形成させて標的を阻害し続ける一方で,任意の
タイミングで相補鎖を加えることで解毒ができることも実証した(図)。なお前述した血清中安定性は、ペプチドよりも更に生体内での加水分解耐性が低い核酸型TCI においても
確認されている。具体的には、thrombin 蛋白質結合性のDNA 型TCI において、エキソおよびエンドヌクレアーゼを含む血清中でインキュベートした際に、共有結合後でのヌクレアーゼ耐性獲得が見られた(図のinset)。
③今後の研究の主な方向性:
・DNA-aptameric TCI の直接選択法の確立
・bioTCI の標的結合前の安定性向上
・標的蛋白質に形成される特異的反応場(matchmaking microenvironment)での反応機構解明
・bioTCI の全体的な分子構造(モダリティー)の拡張
など
よくあるQ&A
コアタイムは何時から何時まで?ブラック研究室って聞くけど本当?

完全フレックスです。
B4を指導するために朝早くからラボに来てくれる院生や、自分の研究のために夜遅くまで残って実験している先輩は多いです。
先生や先輩が居残りを強要することは一切ありません。寧ろさっさと帰宅してしっかり休むことを推奨しています。
この分野では一晩の遅れで時代遅れになりかねないことをラボメンバーの多くが自覚し、尚且つ研究そのものを楽しんでいるため、他研究室より長時間自主的に研究活動を行っています。それがブラック研究室と噂が立つ所以かもしれません。

アルバイトってできる?
アルバイトをしている学生は若干名いますが、やはり研究に専念することが望ましいです。
それでも生活費を自力で稼がなければいけない学生には、極力学業に関わる方法を奨励しています。
たとえば、TA(ティーチングアシスタント)制度の利用や、修士1年から給与が発生するOIコースの奨励、その他にも給付型の奨学金を受給できるよう瀧先生が全力で申請書作成等を支援してくれます。

卒業生の就職先は?
こちらのページをご覧ください。
卒業生の職業例
最初から生物系の研究に興味があって電通大に入った?
電気通信大学は学部入試で生物が無いことから察せるように、生物系だけに強い興味があって来ているという人は少ないと思います。実際、現在のラボメンバーも入学当時生物系に一切興味なかった人もいれば、研究室に入るときに興味を持ったという人もいます。
この大学は生物や化学に関する授業が少ないため、研究室に入ってからついていけるか不安になる学生も多いかと思いますが、先輩や先生が基本から教えてくれるので心配しなくて大丈夫です。授業で物足りない学生は、所属していなくても積極的に瀧研に聞きに来てください。

